De acuerdo a trabajos sobre conformación nasal de los doctores Juan José Álvarez Vicent, Juan Ramón Lacalla y Remigio Francisco Esteban Ortega” RINOMANOMETRÍA ANTERIOR INFORMATIZADA” al describir la nariz externa y su conformación anatómica, afirman que: “La pirámide nasal está constituida por una bóveda ósea, una bóveda cartilaginosa y el lóbulo nasal, estructura dinámica de la pirámide nasal. La pirámide ósea la forman los huesos nasales, que cefálicamente se unen a la glabela del hueso frontal, constituyendo una zona muy gruesa de hueso diploico o compacto.
Sus bordes laterales se unen a la apófisis ascendente del maxilar superior, también gruesa en su porción cefálica. Al nivel de su borde interno, los huesos nasales se unen entre sí y con la lámina perpendicular del etmoides, para conferir mayor resistencia al dorso nasal.
Por su parte la apófisis ascendente del maxilar se une lateralmente al hueso unguis formando el canal lagrimal. Al nivel caudal, los huesos nasales y la apófisis ascendente forman el orificio piriforme, donde se aprecia en el centro de su borde inferior la espina nasal, cuyos bordes laterales están más elevados que el suelo de la fosa nasal. La pirámide cartilaginosa está constituida por dos cartílagos, el lateral superior o triangular y el lateral inferior o alar, que constituye junto con el tejido fibroadiposo el lóbulo nasal.
El cartílago lateral superior tiene forma irregular, ligeramente pentagonal. Su borde interno se une al contralateral para constituir el dorso nasal, dejando entre 12 ambos al borde dorsal del cartílago septal o cuadrangular. No obstante, estos tres elementos forman una unidad, sin distinción, denominada cartílago septolateral. Cefálicamente, el cartílago lateral superior se coloca por debajo del borde caudal del hueso nasal, a unos 2 a 3 mm del mencionado borde, lo que parece que confiere solidez al dorso.
El cartílago lateral inferior o alar consta de una porción medial o crus medialis, que junto con la crus medialis contralateral constituyen la columela; y otra lateral o crus lateralis, que forma el ala nasal.
El pie del ala nasal no tiene soporte cartilaginoso, sino que está formado por tejido fibroso. En su borde cefálico el cartílago lateral inferior está cubriendo al lateral superior, aunque no contactan. El espacio entre ambos cartílagos está ocupado por tejido fibroadiposo.”
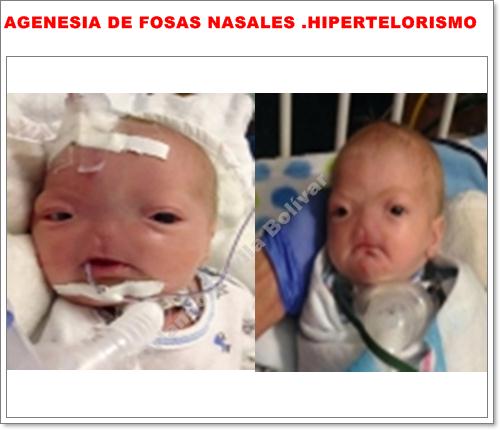
Para el caso concreto de la anomalía presentada por el niño Eli Thompson, la cual ha sido reportada como agenesia de nariz (arhinia), y el caso más o menos parecido que hubo en la menor Cassidy Hooper, podríamos hacer el siguiente análisis acerca de las posibles causas para la presentación de la agenesia fe fosas nasales.
Es ésta en realidad una anomalía consecuencia de un déficit en el desarrollo de la línea medio-facial, con anomalías internas que involucran al primer(I) par de nervios craneales, el Olfatorio, y es muy probable que sea una consecuencia de la morfogénesis incompleta del prosencéfalo. Hubo desarrollo pobre de estructuras nasales externas, cornetes, senos paranasales y agenesia de fosas nasales externas y coanas, epitelio nasal y epitelio respiratorio, es decir agenesia de cavidades nasales y por consiguiente, poco o casi nada de desarrollo de estructura nasal externa.
Existió, bien una falla de inducción de las Células de la cresta neural sobre el ectodermo superficial de la prominencia frontonasal, para que a inicios de la cuarta semana, días 21-22, fecha en la cual aparecen regularmente todas las placodas ectodérmicas craneales, se formara la fosita nasal, engrosamiento de ectodermo; o bien pudo haber existido falla en los transductores FGF8, Factores BMP y SHH, de Pax y los genes Hox. Ahora bien, se ha comprobado que el desarrollo de la prominencia frontonasal está regulado por un grupo de señales provenientes de dos centros de señalización localizados en el epitelio nasal y la FEZ (Zona ectodermica frontonasal) Es en estos centros de señalización donde se concentran la secreción de varias moléculas como FGF8, BMP y SHH, y los genes Six1 y Six4, indispensables para que se forme el epitelio olfatorio involucradas en mediar procesos de proliferación y apoptosis del mesénquima nasal.
No se debe olvidar que:
1.Los genes Notch1, Serrate2, Hes1 y Hey1 se expresan durante el desarrollo temprano en las prominencias maxilar, mandibular y frontonasal, sugiriendo un rol potencial de estos componentes en la morfogénesis facial. 2.La expresión simultanea de Notch1, Serrate2, Hes1 y Hey1, en células epiteliales que recubren las prominencias maxilar y mandibular en los estadios de desarrollo HH19 y HH21, como también la co-expresión de Notch1, Serrate2 y Hey1 en el mesénquima mandibular y el epitelio nasal desde HH21-HH25, sugieren que la activación de la vía Notch se hace a través de la interacción receptor Notch1- ligando Serrate2 que produce la activación transcripcional de los genes Hes1 y Hey1 en estos tejidos.
Decimos esto porque aparentemente sí hubo una formación un poco rudimentaria de alas nasales y dorso de nariz, los cuales se pueden ver en la foto.
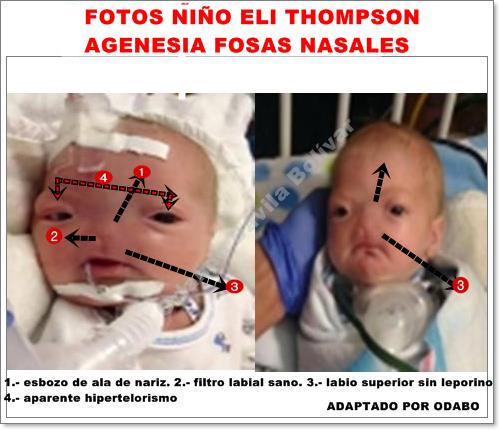
Además para comprobar lo que afirmamos anteriormente, si no se hubiese formado esbozo de procesos nasales laterales ni procesos nasales internos, se habría producido labio leporino, cosa que no pasó, o si no se hubieses unido los dos procesos maxilares con la parte profunda del proceso frontonasal (que debería haber formado el paladar primario ), hubiese existido una manifestación de paladar hendido, bien anterior o posterior y aparentemente, según la historia, no se presentó paladar hendido. Total, la prominencia frontonasal se desarrolló normalmente y ocurrió la fusión normal de procesos nasales laterales con proceso nasal interno. Regularmente lo que debería haber ocurrido es lo siguiente: Las fositas olfatorias conformadas en la cuarta semana, se profundizan en el mesodermo subyacente, de modo que estos sacos de ectodermo encuentran transitoriamente separadas del estomodeo por la membrana buconasal. Hacia finales de la VI semana, las membranas buconasales desaparecen y las fositas nasales comunican ahora con la cavidad oral, comunicación conocida como coana primitiva y que está dispuesta por detrás del paladar primario.
A partir de tercer mes fecha, comienzan a formarse evaginaciones del epitelio de la fosa nasal que se extienden hacia los huesos maxilar (III mes), etmoides (V mes), esfenoides (V mes) y frontal (VI mes) formándose así los primordios de los senos paranasales; cavidades que completan su desarrollo en la adolescencia. Acá no hay proliferación de fosita nasal, por consiguiente no hubo epitelio ectodérmico que formase los senos paranasales en huesos frontal, bula etmoidales y seno maxilar, por consiguiente no hay senos paranasales en el niño Thompson. Por último, algunas células de las placodas olfatorias se diferencian para formar el epitelio neurosensorial olfativo, tejido que se ubica en la región dorsal (techo) de las fosas nasales; este diferenciación debería haber ocurrido normalmente en la V semana de desarrollo intrauterino, pero no fue así, y en el techo de la fosa nasal, a través de la lámina cribosa del etmoides no se formaron los bulbos olfatorios, configuraciones nerviosas que son esbozo del primer par de nervios craneales.
En la figura de un corte coronal de cráneo vemos las estructuras de fosas nasales que no se formaron en el pequeño Thompson.
Corte coronal de cráneo para ver fosas craneales. Fosas nasales y cavidad oral
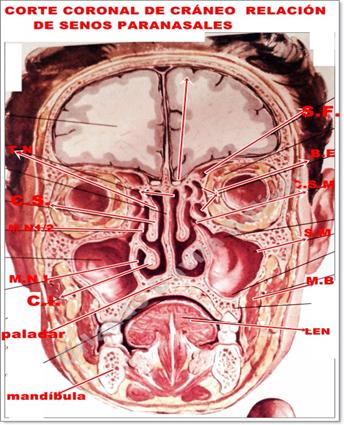
No conocemos si en el caso del niño Thompson existe un paladar adecuado, y si lo que falta es la conformación de la cavidad nasal o rinofaringe anatómica.
Con los datos que hay en la publicación es insuficiente para saber bien la etiología, sin embargo, algo debió haber ingerido haberse inyectado, o ser víctima de virus, irradiación o algún agente teratógeno por parte de la madre en los dos primeros meses, de forma que se manifestó ese daño cuando se deberían haberse formado las fositas nasales, profundizarse y llegar a la faringe. El daño debió haber sido pues un impedimento, bien en la acción de los transductores SX1, SX4, BMP, SHH, y PAX, o una falla en la recepción de estos estímulos sobre el ectodermo que iba a formar epitelio de fosa nasal; o falla de inducción de parte de células de la cresta neural de en la formación de cavidad nasal propiamente dicha y lo más seguro epitelio olfatorio(no llegaron las células de la cresta neural a este lugar). Al no haber formación y profundización de fositas nasales no hubo inducción sobre los huesos maxilar, frontal y etmoides para que se formaran senos paranasales.
Nos atreveríamos a pensar que es ésta una modificación o nueva manifestación de una arrinencefalia, no arhinia, como han mencionado en un escrito, y decimos lo anterior pues el denominado l síndrome malformativo de la holoprosencefalia (arrinencefalia), está caracterizado por anomalías de variable severidad de cerebro y cara, es consecuencia de la morfogénesis incompleta del prosencéfalo y de un déficit en el desarrollo de la línea medio-facial.
ORLANDO DÁVILA BOLÍVAR
M.S. MORFOLOGÍA
PROFESOR ESCUELA DE MEDICINA DE UNIVERSIDAD INTERAMERICANA DE CIENCIA Y TECNOLOGÍA (U.L.A.C.Y.T.) PANAMÁ. REP. DE PANAMÁ.
BIBLIOGRAFÍA
Initiation of olfactory placode development and neurogenesis is blocked in mice lacking both Six1 and Six4
Binglai Chen, Eun-Hee Kim, Pin-Xian Xu
Dev Cell. 2013 Aug 26;26(4):416-30. doi: 10.1016/j.devcel.2013.06.018.
Homeoproteins Six1 and Six4 regulate male sex determination and mouse gonadal development.
Fujimoto Y1, Tanaka SS, Yamaguchi YL, Kobayashi H, Kuroki S, Tachibana M, Shinomura M, Kanai Y, Morohashi K, Kawakami K, Nishinakamura R
Development. 2005 May;132(9):2235-49. Epub 2005 Mar 23.
Six1 and Six4 homeoproteins are required for Pax3 and Mrf expression during myogenesis in the mouse embryo.
Grifone R1, Demignon J, Houbron C, Souil E, Niro C, Seller MJ, Hamard G, Maire P.
The cranial sensory nervous system: specification of sensory progenitors and placodes*
Andrea Streit.
Dev Biol. 2006 Jun 15;294(2):303-51. Epub 2006 May 3.
Induction and specification of cranial placodes.
Int J Dev Biol. 2007;51(6-7):463-72.
The first steps towards hearing: mechanisms of otic placode induction.
Ohyama T1, Groves AK, Martin K.
Int J Dev Biol. 2007;51(6-7):447-61.
The preplacodal region: an ectodermal domain with multipotential progenitors that contribute to sense organs and cranial sensory ganglia.
Streit A1.
Development. 2006 Mar;133(5):877-87. Epub 2006 Feb 1.
Competence of cranial ectoderm to respond to Fgf signaling suggests a two-step model of otic placode induction.
Biol Cell. 2005 May;97(5):303-19.
Induction and specification of the vertebrate ectodermal placodes: precursors of the cranial sensory organs.
J Exp Zool B Mol Dev Evol. 2005 Jul 15;304(4):347-99.
Evolutionary origins of vertebrate placodes: insights from developmental studies and from comparisons with other deuterostomes.
ScientificWorldJournal. 2006 Apr 4;6:1841-50.
The evolution of sensory placodes.
Mol Biol Evol. 2015 Feb; 32(2): 299–312.
Published online 2014 Nov 17. doi: 10.1093/molbev/msu319
PMCID: PMC4298178
Phylostratigraphic Profiles in Zebrafish Uncover Chordate Origins of the Vertebrate Brain
Martin Sebastijan Šestak1 and Tomislav Domazet-Lošo
Dev Biol. 2014 May 1;389(1):98-119. doi: 10.1016/j.ydbio.2014.01.019. Epub 2014 Feb 1.
The evolutionary history of vertebrate cranial placodes II. Evolution of ectodermal patterning.
Schlosser G1, Patthey C2, Shimeld SM2.

